Les changement d’état de l’eau
1) Structure de la molécule d’eau
A) Liaison covalente
B) La bipolarité de la molécule d’eau
2) Les interaction intermoléculaires
A) La liaison hydrogène
B) Rôle des liaisons Hydrogène dans l’organisation des molécules d’eau
A) Condition de changement d’état
B) L’originalité des molécules d’eau
 |
|
|
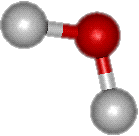
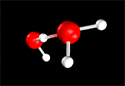
La molécule d’eau est composée de 2 atomes d’hydrogène et d’un atome d’oxygène : H2O. Dans cette molécule, chaque atome d’hydrogène est relié à l’atome d’oxygène par ce que l’on appelle une liaison covalente : la liaison OH. Dans cette liaison, relativement solide, l’atome d’hydrogène a besoin d’un électron pour acquérir une configuration stable (avec sa couche électronique externe complète). L’oxygène, avec six électrons sur sa couche externe L, est susceptible de gagner deux électrons pour la compléter. Les atomes vont ainsi mettre en commun chacun un (pour les H) ou deux (pour l'O) électrons. Ces atomes vont donc chacun acquérir un ou deux électrons supplémentaires. Cela va conférer à la molécule une grande stabilité. |
B) La bipolarité de la molécule d’eau
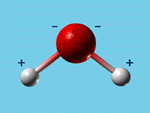
Le « partage » des électrons entre les atomes n’est pas toujours équitable : certains atomes peuvent attirer plus d’électrons que d’autres. C’est le cas dans la molécule d’eau, où l’oxygène a tendance à capter plus fortement les électrons que l’hydrogène. Dans cette molécule, la charge négative des électrons engagés dans les liaisons n’est donc pas répartie de manière homogène entre les atomes d’hydrogènes et d’oxygène : l’atome d’oxygène est chargé négativement et l’atome d’hydrogène positivement. On dit d’une telle molécule qu’elle est dipolaire. Cette bipolarité est une propriété.
2) Les interaction intermoléculaires
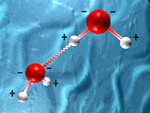
Elle s’établit entre un atome d’oxygène, chargé négativement, du fait de son electronégativité et deux atomes d’hydrogène des molécules voisines, chargé positivement. C’est donc une liaison électrostatique, semblable à toutes les liaisons de valence. On la note : O-H…O. Elle est directionnel, c’est à dire qu’il se forme un axe entre les atomes O et H de la première molécule et l’atome O de la seconde. Cela permet de configurer des architectures moléculaires bien définies.
De plus l’énergie de sa formation est proche de celle des fluctuations thermiques à température ambiante.
B) Rôle des liaisons Hydrogène dans l’organisation des molécules d’eau
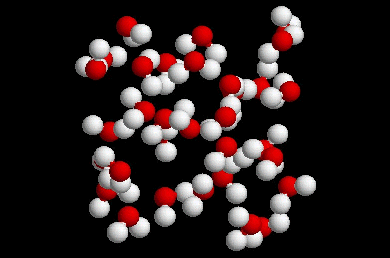
Les liaisons
O-H…O n’ont aucun rôle. Les molécules libres se déplacent séparément
les une des autres, ou en très petits groupes, engendrant trop d’énergie du
à leur déplacement, pour que les liaisons O-H…O se mettent en place.

|
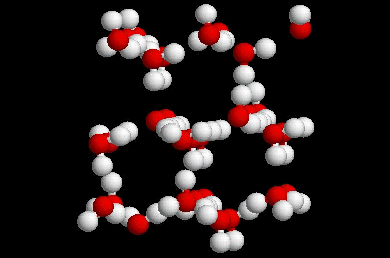
L’agitation thermique est assez faible pour que les liaisons se forment. Cependant Elle est encore suffisante pour que ces dernières ne se rigidifient pas complètement : les liaisons forment se tordent se cassent à un rythme très élevé et les molécules ne son pas figé entre elles
|
|
L’agitation thermique des molécules est réduite au minimum : les molécules se lient complètement et les liaisons tendent à devenir le plus rectiligne possible. Les molécules ne peuvent alors plus change de position. Elles forment des structures bien précise ou chaque atome d’oxygène est le centre d’un Tétraèdre dont tous les sommets sont occupés par les atomes d’oxygène des molécules voisines. Cependant, dans certaines conditions (pressions élevées) les molécules se lient selon des structures particulières qui diffèrent du tétraèdre.
|
A) Condition de changement d’état
L’augmentation de la température et de la pression fait augmenter l’agitation moléculaire. Or lorsque la liaison hydrogène n’est plus assez puissante pour résister à cette agitation, elle se rompt et ainsi on passe de la configuration de la glace à celle de liquide, puis à celle de vapeur. Donc les facteurs influents sur les changements d’état de l’eau sont principalement la température et la pression.
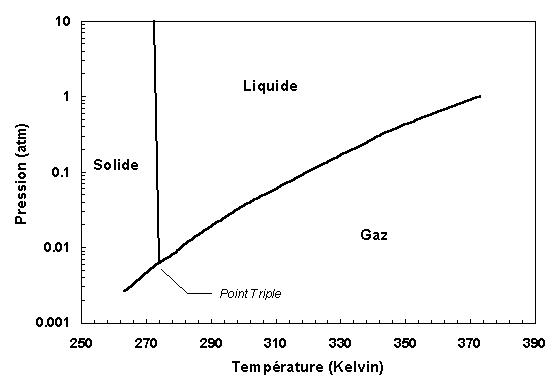
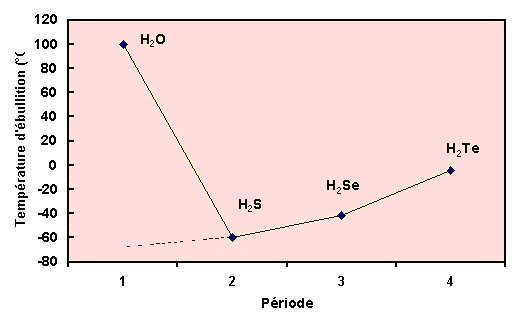
L’eau H20 devrait avoir, en comparaison avec H2Te, H2Se et H2S ( Te, Se et S étant des chalcogene comme O), un point de fusion de –110°C et d’ébullition de –80°C. C’est la particularité de sa structure due aux liaisons hydrogènes beaucoup plus puissantes que pour les autres corps qui demandent plus d’Energie avant de se rompre (donc une température et une pression plus élevée).
L’eau de tous les jours
L’eau est la seule substance de la biosphère qui y existe dans les trois états physiques de la matière. C’est également le seul corps composé inorganique que l’on y rencontre à l’état liquide.
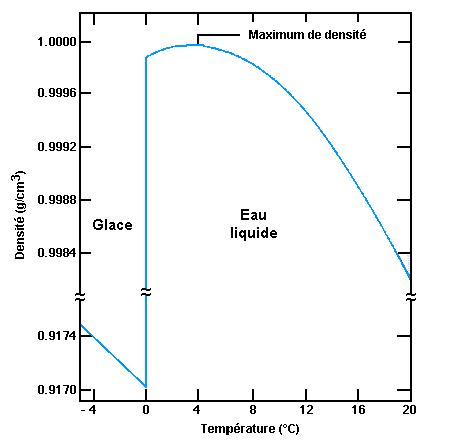
Lors d’un réchauffement il s’en suit une augmentation du volume occupé. L’amplitude de ce mouvement est proportionnelle à la température appliquée. Or lorsque l’on fait fondre de la glace, cet effet va à l’encontre de la contraction liée à l’établissement des liaisons hydrogénées dans le liquide. Il existe donc un maximum de masse volumique pour l’eau.